- OXYDORÉDUCTIONS BIOLOGIQUES
- OXYDORÉDUCTIONS BIOLOGIQUESLes oxydoréductions, réactions couplées par lesquelles une substance se réduit en prélevant des électrons à une autre qui s’oxyde, sont des étapes essentielles dans les biodégradations et les biosynthèses. Leurs mécanismes sont bien connus, et la connaissance du potentiel d’oxydoréduction permet de prévoir le sens des échanges. Des transporteurs d’électrons, reliant des métabolites plus ou moins éloignés, confèrent à la machinerie métabolique cohésion et souplesse, tandis que des processus générateurs de composés à haut potentiel énergétique, tel l’adénosine triphosphate (ATP), permettent aux cellules et aux organismes de disposer à point nommé de l’énergie que les oxydoréductions retirent des aliments et des assimilats.1. La notion d’oxydoréductionIl y a oxydoréduction entre deux composés (ou groupe de composés) lorsque l’un d’eux s’oxyde tandis que l’autre se réduit. Pour mieux saisir le sens et l’intérêt de cette notion en biologie, voyons comment elle a pris corps.Le rôle de l’oxygèneL’idée d’une certaine analogie entre la vie et le feu est fort ancienne et se retrouve dans le langage commun, où l’on «brûle de passion», on n’a plus qu’une «étincelle de vie» et, pour finir, «on s’éteint». C’est Lavoisier qui montra qu’il ne s’agissait pas là d’une simple image, mais bien d’une réalité, en établissant que les échanges gazeux sont les mêmes dans la respiration et la combustion. Ce qui lui permit d’écrire en 1789, dans son Premier Mémoire sur la respiration des animaux : «La respiration n’est qu’une combustion lente de carbone et d’hydrogène, qui est semblable en tout à celle qui s’opère dans une lampe ou dans une bougie allumée, et, sous ce point de vue, les animaux sont de véritables combustibles qui brûlent et se consument.»Autrement dit, les échanges gazeux de la respiration traduisent, comme dans la combustion, une fixation d’oxygène , c’est-à-dire une oxydation , non seulement productrice de chaleur, mais source de l’énergie nécessaire à toute activité vitale.Cette conception fut remise en cause par les expériences de Pasteur sur la levure (1854-1864), qui prouvèrent que ce micro-organisme pouvait vivre et croître en absence d’oxygène, la fermentation (alcoolique) se substituant alors à la respiration. Cette capacité était ensuite décelée, du moins pour un court temps d’asphyxie, chez les végétaux supérieurs (Lechartier et Bellamy, 1869), puis chez les animaux (Pflüger, 1875). L’oxydation par l’oxygène n’est donc pas le seul processus susceptible de libérer l’énergie contenue dans les aliments pour la rendre utilisable par le métabolisme.L’intervention de l’hydrogèneLa contradiction fut levée lorsque les chimistes eurent constaté que l’on pouvait parler d’oxydation non seulement pour la fixation d’un oxygène (R + ORO), mais aussi pour la libération de deux hydrogènes (R + H2ORO + 2 H). L’opération inverse, la réduction , peut de même être effectuée par le départ d’un O ou par la fixation de 2 H. Le couplage entre l’oxydation d’un composé et la réduction d’un autre, ou oxydoréduction , peut donc consister dans le transfert d’un O, ou en sens inverse dans celui de 2 H, d’un composé (ou d’un groupe de composés) à un autre.C’est ainsi que les travaux sur la fermentation alcoolique (Wieland, 1912-1922) montrèrent que la dégradation du glucose en alcool, selon l’équation globale due à Gay-Lussac (1810):
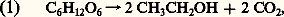 était à scinder en plusieurs étapes, dont certaines comportent des transferts d’hydrogène. Plus précisément, les recherches de Embden, Meyerhof et Parnas, de 1920 à 1933, établirent que la dégradation du glucose par la levure comportait deux séquences de réactions:– la première, qui se retrouve dans la respiration, est la glycolyse , au cours de laquelle une oxydoréduction prélève 4 H et les transfère sur un transporteur, le NAD (cf. infra , Les transporteurs d’électrons ), qui est donc réduit; la séquence s’achève par la production d’acide pyruvique ; la glycolyse peut être résumée par:
était à scinder en plusieurs étapes, dont certaines comportent des transferts d’hydrogène. Plus précisément, les recherches de Embden, Meyerhof et Parnas, de 1920 à 1933, établirent que la dégradation du glucose par la levure comportait deux séquences de réactions:– la première, qui se retrouve dans la respiration, est la glycolyse , au cours de laquelle une oxydoréduction prélève 4 H et les transfère sur un transporteur, le NAD (cf. infra , Les transporteurs d’électrons ), qui est donc réduit; la séquence s’achève par la production d’acide pyruvique ; la glycolyse peut être résumée par: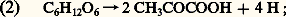 – la seconde séquence, propre à la fermentation (cf. FERMENTATIONS, tableau général), débute par la décarboxylation de l’acide pyruvique en acétaldéhyde:
– la seconde séquence, propre à la fermentation (cf. FERMENTATIONS, tableau général), débute par la décarboxylation de l’acide pyruvique en acétaldéhyde: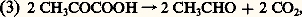 lequel acétaldéhyde reçoit, par une nouvelle oxydoréduction, les 4 H transportés par le NAD, et se trouve ainsi réduit en éthanol (alcool éthylique):
lequel acétaldéhyde reçoit, par une nouvelle oxydoréduction, les 4 H transportés par le NAD, et se trouve ainsi réduit en éthanol (alcool éthylique): La somme des réactions (2), (3) et (4) est bien équivalente à la réaction (1).Dans la respiration, la dégradation de l’acide pyruvique est beaucoup plus complexe, et comporte de nombreuses oxydoréductions qui, finalement, aboutissent à la réduction de l’oxygène avec formation d’eau. Mais cette réduction ne peut s’interpréter correctement que dans le cadre d’une conception élargie de la notion d’oxydoréduction, qui constitue la troisième étape de l’histoire de cette notion.La conception moderneLorsque le fer est lié à l’oxygène, il peut l’être sous forme d’oxyde ferreux, FeO, ou d’oxyde ferrique, Fe23 (pour ne citer que les deux formes principales). On passe de l’une à l’autre par une oxydation:
La somme des réactions (2), (3) et (4) est bien équivalente à la réaction (1).Dans la respiration, la dégradation de l’acide pyruvique est beaucoup plus complexe, et comporte de nombreuses oxydoréductions qui, finalement, aboutissent à la réduction de l’oxygène avec formation d’eau. Mais cette réduction ne peut s’interpréter correctement que dans le cadre d’une conception élargie de la notion d’oxydoréduction, qui constitue la troisième étape de l’histoire de cette notion.La conception moderneLorsque le fer est lié à l’oxygène, il peut l’être sous forme d’oxyde ferreux, FeO, ou d’oxyde ferrique, Fe23 (pour ne citer que les deux formes principales). On passe de l’une à l’autre par une oxydation: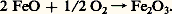 Le fer de FeO est donc sous forme réduite, alors que dans Fe23 il est sous forme oxydée, au sens donné plus haut à ces termes. Mis en présence de HCl (acide chlorhydrique), dans des conditions convenables, FeO donne FeCl2, chlorure ferreux, et Fe23 donne FeCl3, chlorure ferrique. En solution, le fer de FeCl2 est ionisé en Fe2+ et celui de FeCl3 en Fe3+. Or les deux ions, le ferreux Fe2+ et le ferrique Fe3+, ne diffèrent que par un électron e size=1漣:
Le fer de FeO est donc sous forme réduite, alors que dans Fe23 il est sous forme oxydée, au sens donné plus haut à ces termes. Mis en présence de HCl (acide chlorhydrique), dans des conditions convenables, FeO donne FeCl2, chlorure ferreux, et Fe23 donne FeCl3, chlorure ferrique. En solution, le fer de FeCl2 est ionisé en Fe2+ et celui de FeCl3 en Fe3+. Or les deux ions, le ferreux Fe2+ et le ferrique Fe3+, ne diffèrent que par un électron e size=1漣: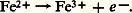 Ainsi l’oxydation (dans le cas du fer pris comme exemple, mais il est généralisable) peut-elle être considérée comme une perte d’électron(s) et la réduction comme un gain d’électron(s). Et l’oxydoréduction, dans l’acception la plus générale du terme, est le transfert d’un ou de plusieurs électrons d’un système qui s’oxyde en cédant des électrons à un autre qui se réduit.Les conceptions antérieures n’envisageaient donc que des cas particuliers, où les électrons accompagnent des noyaux d’oxygène ou des noyaux d’hydrogène (protons). Par exemple, l’équation (2) qui résume la glycolyse peut s’écrire, en explicitant les transferts d’électrons:
Ainsi l’oxydation (dans le cas du fer pris comme exemple, mais il est généralisable) peut-elle être considérée comme une perte d’électron(s) et la réduction comme un gain d’électron(s). Et l’oxydoréduction, dans l’acception la plus générale du terme, est le transfert d’un ou de plusieurs électrons d’un système qui s’oxyde en cédant des électrons à un autre qui se réduit.Les conceptions antérieures n’envisageaient donc que des cas particuliers, où les électrons accompagnent des noyaux d’oxygène ou des noyaux d’hydrogène (protons). Par exemple, l’équation (2) qui résume la glycolyse peut s’écrire, en explicitant les transferts d’électrons: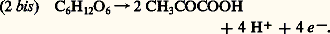 Un système chimique S (substance ou groupe de substances) susceptible d’exister sous deux formes, l’une réduite Sréd, l’autre oxydée Sox, différant par n électrons et tel que:
Un système chimique S (substance ou groupe de substances) susceptible d’exister sous deux formes, l’une réduite Sréd, l’autre oxydée Sox, différant par n électrons et tel que: est dit système d’oxydoréduction , en abrégé système rédox .Il y a oxydoréduction lorsque l’oxydation d’un système A est couplée à la réduction d’un système B:
est dit système d’oxydoréduction , en abrégé système rédox .Il y a oxydoréduction lorsque l’oxydation d’un système A est couplée à la réduction d’un système B: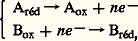 ce qui correspond bien à la définition donnée en introduction.2. Le potentiel d’oxydoréductionLorsque deux systèmes rédox sont mis en présence, lequel des deux va réduire l’autre? La considération du potentiel d’oxydoréduction permet de répondre à la question.DéfinitionLe potentiel d’oxydoréduction – en abrégé potentiel rédox – est une grandeur thermodynamique qui mesure le pouvoir oxydant ou réducteur d’un système rédox. Plus un système est oxydant, c’est-à-dire plus il est apte à se réduire en captant des électrons, et plus son potentiel d’oxydoréduction est élevé. Plus il est réducteur et a tendance à céder des électrons, et plus son potentiel rédox est bas.Pour définir le potentiel d’oxydoréduction d’un système S, imaginons que ce système soit mis dans le compartiment A d’une pile, dont le compartiment B contient un système de référence R (fig. 1). Si S est plus oxydant que R, il va capter des électrons à ce dernier, d’où un courant d’électrons de B à A, c’est-à-dire un courant électrique de A à B (le sens du courant, arbitrairement choisi, est inverse de celui de la marche des électrons). La différence de potentiel ainsi créée est, par définition, le potentiel d’oxydoréduction de S, positif si S est plus oxydant que R, négatif s’il est plus réducteur.Le système de référence est une électrode normale à hydrogène H2 gazeux, sous 1 atmosphère (1 013 hectopascals), barbotant dans une solution de pH = 0, fournissant des électrons selon la réaction: H22 H+ + 2 e size=1漣. Le potentiel normal d’oxydoréduction, qui s’exprime en volts (ou en mV), se mesure avec des concentrations unimolaires (1 mol l size=1漣1), à 0 0C (273 K), et selon le pH, on le désigne par E0, en chimie à pH = 0, et, en biologie, à pH = 7, on le désigne par E 0. Avec d’autres concentrations et une autre température, le potentiel est donné par la relation de Nernst:
ce qui correspond bien à la définition donnée en introduction.2. Le potentiel d’oxydoréductionLorsque deux systèmes rédox sont mis en présence, lequel des deux va réduire l’autre? La considération du potentiel d’oxydoréduction permet de répondre à la question.DéfinitionLe potentiel d’oxydoréduction – en abrégé potentiel rédox – est une grandeur thermodynamique qui mesure le pouvoir oxydant ou réducteur d’un système rédox. Plus un système est oxydant, c’est-à-dire plus il est apte à se réduire en captant des électrons, et plus son potentiel d’oxydoréduction est élevé. Plus il est réducteur et a tendance à céder des électrons, et plus son potentiel rédox est bas.Pour définir le potentiel d’oxydoréduction d’un système S, imaginons que ce système soit mis dans le compartiment A d’une pile, dont le compartiment B contient un système de référence R (fig. 1). Si S est plus oxydant que R, il va capter des électrons à ce dernier, d’où un courant d’électrons de B à A, c’est-à-dire un courant électrique de A à B (le sens du courant, arbitrairement choisi, est inverse de celui de la marche des électrons). La différence de potentiel ainsi créée est, par définition, le potentiel d’oxydoréduction de S, positif si S est plus oxydant que R, négatif s’il est plus réducteur.Le système de référence est une électrode normale à hydrogène H2 gazeux, sous 1 atmosphère (1 013 hectopascals), barbotant dans une solution de pH = 0, fournissant des électrons selon la réaction: H22 H+ + 2 e size=1漣. Le potentiel normal d’oxydoréduction, qui s’exprime en volts (ou en mV), se mesure avec des concentrations unimolaires (1 mol l size=1漣1), à 0 0C (273 K), et selon le pH, on le désigne par E0, en chimie à pH = 0, et, en biologie, à pH = 7, on le désigne par E 0. Avec d’autres concentrations et une autre température, le potentiel est donné par la relation de Nernst: (R, constante des gaz parfaits, 8,315 J K size=1漣1 mol size=1漣1; T, température absolue, en K; n , nombre d’électrons échangés; F, constante de Faraday = 96 485 C mol size=1漣1; ln, logarithme népérien = 2,303 log10; les valeurs de S entre crochets correspondant aux activités du système sous forme oxydée et réduite (qui se confondent avec les concentrations en solution diluée). Pratiquement, on se contente des potentiels normaux, qui fournissent des ordres de grandeur suffisants pour prévoir le sens des réactions: si l’on a pris comme référence l’électrode à hydrogène [cf. SOLUTION (ÉQUILIBRES EN)], les potentiels d’oxydoréduction confrontés à ce système de référence présenteront une valeur négative d’autant plus grande que leur pouvoir réducteur sera plus fort, tandis que les systèmes à valeur positive auront un caractère oxydant d’autant plus fort que cette valeur sera élevée (la valeur + 1 caractérisant un système à oxygène libre).Autrement dit, si une substance possède une affinité pour les électrons plus élevée que celle dont est doté l’hydrogène, elle aura un potentiel de réduction positif, mais, si une autre substance a une affinité plus faible pour les électrons que celle qui caractérise l’hydrogène, son potentiel rédox sera négatif.IntérêtSi deux systèmes rédox sont en compétition, les électrons vont du système dont le potentiel rédox est le plus bas (en valeur algébrique) vers celui dont le potentiel rédox est le plus élevé. Dans une chaîne de systèmes – modalité inhérente aux cellules vivantes –, les électrons, s’ils sont libres de leurs déplacements, «remontent» donc les potentiels rédox. Ce n’est que si la chaîne reçoit de l’énergie extérieure que les électrons descendent les potentiels.Ainsi, pour prévoir le sens d’une réaction, le potentiel rédox joue-t-il le même rôle qu’un potentiel thermodynamique, mais en sens inverse (une réaction sans apport d’énergie extérieure s’effectue dans le sens des potentiels thermodynamiques décroissants).C’est pourquoi l’on a pris l’habitude de représenter les potentiels rédox sur des axes verticaux (fig. 2, 4 et 5) qui permettent, en orientant vers le haut les valeurs négatives, de visualiser la «descente thermodynamique» des électrons, comme on le ferait pour un corps qui tombe, alors qu’ils remontent les potentiels rédox.Dans la photosynthèse (fig. 2), grâce à l’énergie lumineuse (h 益) captée par la chlorophylle, les électrons pourront passer du système H22 au système APG/AldPG. Dans la respiration (fig. 3 et 4), les électrons remontent, par des voies d’ailleurs très complexes, les potentiels depuis le système phosphoglycéraldéhyde (Ald PG) et acide phosphoglycérique (APG) résultant de la glycolyse:
(R, constante des gaz parfaits, 8,315 J K size=1漣1 mol size=1漣1; T, température absolue, en K; n , nombre d’électrons échangés; F, constante de Faraday = 96 485 C mol size=1漣1; ln, logarithme népérien = 2,303 log10; les valeurs de S entre crochets correspondant aux activités du système sous forme oxydée et réduite (qui se confondent avec les concentrations en solution diluée). Pratiquement, on se contente des potentiels normaux, qui fournissent des ordres de grandeur suffisants pour prévoir le sens des réactions: si l’on a pris comme référence l’électrode à hydrogène [cf. SOLUTION (ÉQUILIBRES EN)], les potentiels d’oxydoréduction confrontés à ce système de référence présenteront une valeur négative d’autant plus grande que leur pouvoir réducteur sera plus fort, tandis que les systèmes à valeur positive auront un caractère oxydant d’autant plus fort que cette valeur sera élevée (la valeur + 1 caractérisant un système à oxygène libre).Autrement dit, si une substance possède une affinité pour les électrons plus élevée que celle dont est doté l’hydrogène, elle aura un potentiel de réduction positif, mais, si une autre substance a une affinité plus faible pour les électrons que celle qui caractérise l’hydrogène, son potentiel rédox sera négatif.IntérêtSi deux systèmes rédox sont en compétition, les électrons vont du système dont le potentiel rédox est le plus bas (en valeur algébrique) vers celui dont le potentiel rédox est le plus élevé. Dans une chaîne de systèmes – modalité inhérente aux cellules vivantes –, les électrons, s’ils sont libres de leurs déplacements, «remontent» donc les potentiels rédox. Ce n’est que si la chaîne reçoit de l’énergie extérieure que les électrons descendent les potentiels.Ainsi, pour prévoir le sens d’une réaction, le potentiel rédox joue-t-il le même rôle qu’un potentiel thermodynamique, mais en sens inverse (une réaction sans apport d’énergie extérieure s’effectue dans le sens des potentiels thermodynamiques décroissants).C’est pourquoi l’on a pris l’habitude de représenter les potentiels rédox sur des axes verticaux (fig. 2, 4 et 5) qui permettent, en orientant vers le haut les valeurs négatives, de visualiser la «descente thermodynamique» des électrons, comme on le ferait pour un corps qui tombe, alors qu’ils remontent les potentiels rédox.Dans la photosynthèse (fig. 2), grâce à l’énergie lumineuse (h 益) captée par la chlorophylle, les électrons pourront passer du système H22 au système APG/AldPG. Dans la respiration (fig. 3 et 4), les électrons remontent, par des voies d’ailleurs très complexes, les potentiels depuis le système phosphoglycéraldéhyde (Ald PG) et acide phosphoglycérique (APG) résultant de la glycolyse: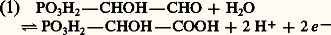 système très réducteur et de potentiel E 0 = 漣 0,42 V, jusqu’au système 2/H2O:
système très réducteur et de potentiel E 0 = 漣 0,42 V, jusqu’au système 2/H2O: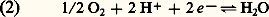 très oxydant et de potentiel E 0 + 0,82 V.3. Les transporteurs d’électronsEn général, les oxydoréductions biologiques ne s’effectuent pas directement entre les deux métabolites intéressés, mais par l’intermédiaire de transporteurs d’électrons souvent accompagnés de protons. Ils peuvent êtrefixés sur une membrane et assurent alors le transport des électrons d’un site réactionnel de cette membrane à un autre. Ils peuvent aussi être mobiles, s’incorporer au pool métabolique du cytosol cellulaire et permettre l’échange d’électrons entre des métabolites très éloignés, parfois même situés dans des organites différents.Les transporteurs sont soit des enzymes, dont le site actif est oxydoréducteur, soit des coenzymes libres. De toute manière, les oxydoréductions exigent pour se réaliser la présence d’une structure protéique, qui assure la spécificité de la réaction.Les nucléotidesLe nicotinamide-adénine-dinucléotide ou NAD (tabl. 1, formules 1) est un dérivé de la nicotinamide, ou vitamine PP, antipellagreuse. C’est un coenzyme libre. Sous sa forme oxydée (NAD+) et en présence d’une enzyme appropriée, il réalise l’oxydation du substrat en le déshydrogénant, avec libération d’un H+ dans le milieu:
très oxydant et de potentiel E 0 + 0,82 V.3. Les transporteurs d’électronsEn général, les oxydoréductions biologiques ne s’effectuent pas directement entre les deux métabolites intéressés, mais par l’intermédiaire de transporteurs d’électrons souvent accompagnés de protons. Ils peuvent êtrefixés sur une membrane et assurent alors le transport des électrons d’un site réactionnel de cette membrane à un autre. Ils peuvent aussi être mobiles, s’incorporer au pool métabolique du cytosol cellulaire et permettre l’échange d’électrons entre des métabolites très éloignés, parfois même situés dans des organites différents.Les transporteurs sont soit des enzymes, dont le site actif est oxydoréducteur, soit des coenzymes libres. De toute manière, les oxydoréductions exigent pour se réaliser la présence d’une structure protéique, qui assure la spécificité de la réaction.Les nucléotidesLe nicotinamide-adénine-dinucléotide ou NAD (tabl. 1, formules 1) est un dérivé de la nicotinamide, ou vitamine PP, antipellagreuse. C’est un coenzyme libre. Sous sa forme oxydée (NAD+) et en présence d’une enzyme appropriée, il réalise l’oxydation du substrat en le déshydrogénant, avec libération d’un H+ dans le milieu: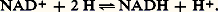 Inversement, la réduction par la forme réduite (NADH) s’effectue par une hydrogénation du substrat, avec incorporation d’un H+ pris au milieu. Son potentiel rédox normal est 漣 0,32 VLe nicotinamide-adénine-dinucléotide-phosphate ou NADP n’en diffère que par un phosphoryde 漣OP3H2 substitué à un oxhydrile 漣OH de l’un des riboses. Les deux nucléotides ont même site actif (la nicotinamide), donc même mécanisme d’action et même E 0.Le NAD intervient dans les dégradations des glucides (ex. respiration, fig. 3), le NADP dans celles des lipides et dans les biosynthèses (notamment la photosynthèse, fig. 2). Le rôle de ces nucléotides est essentiel dans la production d’ATP où est stockée l’énergie métabolique.Le flavine-mononucléotide ou FMN (cf. tableau, formules 2) est dérivé de la riboflavine ou vitamine B2, constituée de diméthyl-isoalloxazine et de ribitol (il ne s’agit donc pas à proprement parler d’un nucléotide, puisqu’il contient non pas du ribose, mais son dérivé réduit, le ribitol). Il passe de la forme oxydée (FMN) à la forme réduite (FMNH2) par fixation de 2 H sur les 2 N non saturés de l’isoalloxazine.Le FMN n’est pas libre, mais fortement lié à une protéine (qui diffère selon les oxydoréductions contrôlées), formant ainsi une flavoprotéine, par exemple dans le complexe II de la chaîne des oxydations terminales (fig. 4). Il s’agit de liaisons covalentes sur la riboflavine, avec des liaisons électrovalentielles accessoires sur la partie nucléotidique. Les formes réduites sont jaunes (latin flavus : jaune); les formes oxydées incolores. Leur E 0 est 漣 0,06 V.Le flavine-dinucléotide ou FAD est constitué de FMN et d’un autre nucléotide, l’adénosine-monophosphate. Il a les mêmes propriétés d’oxydoréduction que le FMN et, comme lui, est présent dans les cellules sous forme de flavoprotéines. Il assure d’importantes oxydoréductions (par passage du FAD au FADH2 ou inversement), dans la respiration (complexe I, fig. 4), dans la réduction des nitrates (fig. 5), etc.La nitrate réductase, apanage des végétaux, seuls êtres capables de réduire les nitrates, est un énorme complexe (masse moléculaire relative, Mr: 200 000, et même jusqu’à 500 000 chez les végétaux inférieurs), contenant du FAD, un cytochrome et du molybdène. C’est ce dernier qui, par son changement de valence (Mo5+/Mo6+), transmet les e size=1漣 à 3 size=1漣.Les cytochromesLes cytochromes (tabl. 1, formule 3) sont des chromoprotéines, dont le groupement prosthétique est un hème (comme dans l’hémoglobine, c’est-à-dire une porphyrine ayant du fer en son centre). Colorés, de l’orange au brun, ils sont décelables en microscopie optique; ce furent les premiers pigments respiratoires connus (Warburg, 1920; Keilin, 1925). Le fer peut osciller de l’état divalent à l’état trivalent, d’où leur rôle comme transporteurs d’e size=1漣. Les formes oxydée et réduite se distinguant par le spectre d’absorption.La protéine est fortement liée à la porphyrine par des liaisons thio-éther contractées entre les SH de deux cystéines et les restes vinyle de l’hème. Selon la nature de cette protéine, on distingue plusieurs cytochromes, qui ont des E 0 différents.Les plus répandus sont:– dans les oxydations terminales de la respiration (fig. 4), le cytochrome b (Mr: 28 000), en fait constitué des cytochromes b 566 et b 562 (désignés ainsi selon leur principal pic d’absorption), associé au cytochrome c1 dans le complexe III; le cytochrome c (Mr: 12 000); le couple des cytochromes a et a 3, qui forme la cytochrome oxydase ou complexe IV, chacun d’eux y est associé à un ion Cu (oscillant entre Cu+ et Cu2+); le système peut ainsi délivrer 4 e size=1漣 à l’oxygène (2 par les Fe et 2 par les Cu);– dans la photosynthèse, les cytochromes b 563 (ou b 6) et f (initiale de frons , feuille en latin), sans doute associés en un même complexe (bf , E 0: + 0,35 V), contribuent à la grande descente thermodynamique des e size=1漣 entre les deux systèmes photosynthétiques (PS I et PS II, caractérisant le schéma en Z) que présente la figure 2.On peut citer encore le cytochrome b 5, soluble, qui assure la désaturation des acides gras (à partir des acides gras saturés qui sont les premiers synthétisés). C’est également le cytochrome b 5 qui, dans les hématies, ramène à l’état d’hémoglobine (Fe2+) la méthémoglobine (Fe3+) qui a tendance à se former et qui est inactive. Un autre cytochrome fait partie de la nitrate réductase, etc.Les quinonesLes quinones sont des composés cycliques présentant dans leur cycle deux fonctions cétone (face=F0019 漣C = O) susceptibles d’être réduites en fonctions phénol (face=F0019 漣C 漣OH) par capture de 2 H.Dans les ubiquinones ou coenzymes Q, le cycle cétonique est relié à une chaîne de n restes isoprène. Le plus souvent, dans les molécules qui participent aux oxydoréductions (tabl. 1, formules 4), n est égal à 10. Le maximum d’absorption est à 275 nm pour la forme oxydée, à 290 nm pour la forme réduite. Le potentiel rédox est d’environ + 0,10 V. C’est une telle ubiquinone (E 0: 0,065 V) qui, située dans les crêtes mitochondriales, précède les cytochromes dans les oxydations terminales (fig. 4).La plastoquinone est de formule très voisine:
Inversement, la réduction par la forme réduite (NADH) s’effectue par une hydrogénation du substrat, avec incorporation d’un H+ pris au milieu. Son potentiel rédox normal est 漣 0,32 VLe nicotinamide-adénine-dinucléotide-phosphate ou NADP n’en diffère que par un phosphoryde 漣OP3H2 substitué à un oxhydrile 漣OH de l’un des riboses. Les deux nucléotides ont même site actif (la nicotinamide), donc même mécanisme d’action et même E 0.Le NAD intervient dans les dégradations des glucides (ex. respiration, fig. 3), le NADP dans celles des lipides et dans les biosynthèses (notamment la photosynthèse, fig. 2). Le rôle de ces nucléotides est essentiel dans la production d’ATP où est stockée l’énergie métabolique.Le flavine-mononucléotide ou FMN (cf. tableau, formules 2) est dérivé de la riboflavine ou vitamine B2, constituée de diméthyl-isoalloxazine et de ribitol (il ne s’agit donc pas à proprement parler d’un nucléotide, puisqu’il contient non pas du ribose, mais son dérivé réduit, le ribitol). Il passe de la forme oxydée (FMN) à la forme réduite (FMNH2) par fixation de 2 H sur les 2 N non saturés de l’isoalloxazine.Le FMN n’est pas libre, mais fortement lié à une protéine (qui diffère selon les oxydoréductions contrôlées), formant ainsi une flavoprotéine, par exemple dans le complexe II de la chaîne des oxydations terminales (fig. 4). Il s’agit de liaisons covalentes sur la riboflavine, avec des liaisons électrovalentielles accessoires sur la partie nucléotidique. Les formes réduites sont jaunes (latin flavus : jaune); les formes oxydées incolores. Leur E 0 est 漣 0,06 V.Le flavine-dinucléotide ou FAD est constitué de FMN et d’un autre nucléotide, l’adénosine-monophosphate. Il a les mêmes propriétés d’oxydoréduction que le FMN et, comme lui, est présent dans les cellules sous forme de flavoprotéines. Il assure d’importantes oxydoréductions (par passage du FAD au FADH2 ou inversement), dans la respiration (complexe I, fig. 4), dans la réduction des nitrates (fig. 5), etc.La nitrate réductase, apanage des végétaux, seuls êtres capables de réduire les nitrates, est un énorme complexe (masse moléculaire relative, Mr: 200 000, et même jusqu’à 500 000 chez les végétaux inférieurs), contenant du FAD, un cytochrome et du molybdène. C’est ce dernier qui, par son changement de valence (Mo5+/Mo6+), transmet les e size=1漣 à 3 size=1漣.Les cytochromesLes cytochromes (tabl. 1, formule 3) sont des chromoprotéines, dont le groupement prosthétique est un hème (comme dans l’hémoglobine, c’est-à-dire une porphyrine ayant du fer en son centre). Colorés, de l’orange au brun, ils sont décelables en microscopie optique; ce furent les premiers pigments respiratoires connus (Warburg, 1920; Keilin, 1925). Le fer peut osciller de l’état divalent à l’état trivalent, d’où leur rôle comme transporteurs d’e size=1漣. Les formes oxydée et réduite se distinguant par le spectre d’absorption.La protéine est fortement liée à la porphyrine par des liaisons thio-éther contractées entre les SH de deux cystéines et les restes vinyle de l’hème. Selon la nature de cette protéine, on distingue plusieurs cytochromes, qui ont des E 0 différents.Les plus répandus sont:– dans les oxydations terminales de la respiration (fig. 4), le cytochrome b (Mr: 28 000), en fait constitué des cytochromes b 566 et b 562 (désignés ainsi selon leur principal pic d’absorption), associé au cytochrome c1 dans le complexe III; le cytochrome c (Mr: 12 000); le couple des cytochromes a et a 3, qui forme la cytochrome oxydase ou complexe IV, chacun d’eux y est associé à un ion Cu (oscillant entre Cu+ et Cu2+); le système peut ainsi délivrer 4 e size=1漣 à l’oxygène (2 par les Fe et 2 par les Cu);– dans la photosynthèse, les cytochromes b 563 (ou b 6) et f (initiale de frons , feuille en latin), sans doute associés en un même complexe (bf , E 0: + 0,35 V), contribuent à la grande descente thermodynamique des e size=1漣 entre les deux systèmes photosynthétiques (PS I et PS II, caractérisant le schéma en Z) que présente la figure 2.On peut citer encore le cytochrome b 5, soluble, qui assure la désaturation des acides gras (à partir des acides gras saturés qui sont les premiers synthétisés). C’est également le cytochrome b 5 qui, dans les hématies, ramène à l’état d’hémoglobine (Fe2+) la méthémoglobine (Fe3+) qui a tendance à se former et qui est inactive. Un autre cytochrome fait partie de la nitrate réductase, etc.Les quinonesLes quinones sont des composés cycliques présentant dans leur cycle deux fonctions cétone (face=F0019 漣C = O) susceptibles d’être réduites en fonctions phénol (face=F0019 漣C 漣OH) par capture de 2 H.Dans les ubiquinones ou coenzymes Q, le cycle cétonique est relié à une chaîne de n restes isoprène. Le plus souvent, dans les molécules qui participent aux oxydoréductions (tabl. 1, formules 4), n est égal à 10. Le maximum d’absorption est à 275 nm pour la forme oxydée, à 290 nm pour la forme réduite. Le potentiel rédox est d’environ + 0,10 V. C’est une telle ubiquinone (E 0: 0,065 V) qui, située dans les crêtes mitochondriales, précède les cytochromes dans les oxydations terminales (fig. 4).La plastoquinone est de formule très voisine: Située dans les membranes thylacoïdales des chloroplastes, elle reçoit les électrons du système PS II (ainsi nommé, bien qu’il fonctionne en premier, parce qu’il ne fut découvert que le second), et les transmet à la chaîne qui les conduit à PS I (voir schéma fig. 7 de l’article PHOTOSYNTHÈSE).Les protéines fer-soufreDans les protéines fer-soufre (protéines Fe-S), dont l’importance n’est apparue que ces dernières années, le fer est lié au soufre des cystéines par des covalences, mais aussi à du soufre minéral (Si , soufre inorganique) par des liaisons de coordination, selon le schéma:
Située dans les membranes thylacoïdales des chloroplastes, elle reçoit les électrons du système PS II (ainsi nommé, bien qu’il fonctionne en premier, parce qu’il ne fut découvert que le second), et les transmet à la chaîne qui les conduit à PS I (voir schéma fig. 7 de l’article PHOTOSYNTHÈSE).Les protéines fer-soufreDans les protéines fer-soufre (protéines Fe-S), dont l’importance n’est apparue que ces dernières années, le fer est lié au soufre des cystéines par des covalences, mais aussi à du soufre minéral (Si , soufre inorganique) par des liaisons de coordination, selon le schéma: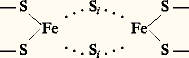 On les voit intervenir dans les oxydations terminales de la respiration (fig. 4: complexes I, II et III). On en trouve également dans la photosynthèse: protéine de Rieske (Rk) et surtout ferrédoxine.La ferrédoxine, petite molécule (PM: 12 000) contenant 2 Fe et 2 Si , très réductrice sous forme réduite (E 0 = 漣 0,42 V). Dans la photosynthèse, sa réduction est obtenue par le fonctionnement du système photosynthétique PS I. Elle peut alors retransmettre les électrons reçus au NADP (fig. 2).Elle sert aussi de transporteur dans la réduction des nitrites, deuxième étape de la réduction des nitrates, dans la réduction des sulfates et dans l’assimilation de l’azote atmosphérique par certaines bactéries, libres dans le sol ou en symbiose dans les nodules des légumineuses. C’est d’ailleurs chez une bactérie fixatrice d’azote (Clostridium ) qu’elle fut d’abord découverte.La nitrogénase, enzyme chef de l’assimilation de l’azote atmosphérique, est formée de deux protéines Fe-S, l’une de Mr 220 000, l’autre de Mr 70 000. La première reçoit sur son fer les électrons venus de la ferrédoxine et, activée par l’ATP (qui en changeant sa conformation élève son E 0), les retransmet à la deuxième protéine, laquelle contient, outre le fer, du molybdène, qui assure la réduction de l’azote (fig. 6).Autres transporteursIl existe un grand nombre de transporteurs dont les interventions sont plus ponctuelles. Nous n’en citerons que quelques-uns.L’acide ascorbique, ou vitamine C (tabl. 1, formules 5), peut céder 2 H en donnant de l’acide déshydroascorbique (désignation d’ailleurs incorrecte, car la fonction acide située sur l’un des OH a disparu). C’est un antioxydant. Notamment, il maintient le fer à l’état ferreux dans la proline hydroxylase qui assure la transformation de la proline en hydroxyproline et qui n’est active que sous forme ferreuse. Les troubles du scorbut (carence en vitamine C) sont, pour une large part, dus à une altération du collagène (constituant essentiel des tissus conjonctifs), par suite d’une déficience en hydroxyproline.Le glutathion, en abrégé GSH, est un tripeptide formé d’acide glutamique, de cystéine et de glycine (tabl. 1, formules 6). Il participe aux oxydoréductions par création d’un pont disulfure entre deux molécules:
On les voit intervenir dans les oxydations terminales de la respiration (fig. 4: complexes I, II et III). On en trouve également dans la photosynthèse: protéine de Rieske (Rk) et surtout ferrédoxine.La ferrédoxine, petite molécule (PM: 12 000) contenant 2 Fe et 2 Si , très réductrice sous forme réduite (E 0 = 漣 0,42 V). Dans la photosynthèse, sa réduction est obtenue par le fonctionnement du système photosynthétique PS I. Elle peut alors retransmettre les électrons reçus au NADP (fig. 2).Elle sert aussi de transporteur dans la réduction des nitrites, deuxième étape de la réduction des nitrates, dans la réduction des sulfates et dans l’assimilation de l’azote atmosphérique par certaines bactéries, libres dans le sol ou en symbiose dans les nodules des légumineuses. C’est d’ailleurs chez une bactérie fixatrice d’azote (Clostridium ) qu’elle fut d’abord découverte.La nitrogénase, enzyme chef de l’assimilation de l’azote atmosphérique, est formée de deux protéines Fe-S, l’une de Mr 220 000, l’autre de Mr 70 000. La première reçoit sur son fer les électrons venus de la ferrédoxine et, activée par l’ATP (qui en changeant sa conformation élève son E 0), les retransmet à la deuxième protéine, laquelle contient, outre le fer, du molybdène, qui assure la réduction de l’azote (fig. 6).Autres transporteursIl existe un grand nombre de transporteurs dont les interventions sont plus ponctuelles. Nous n’en citerons que quelques-uns.L’acide ascorbique, ou vitamine C (tabl. 1, formules 5), peut céder 2 H en donnant de l’acide déshydroascorbique (désignation d’ailleurs incorrecte, car la fonction acide située sur l’un des OH a disparu). C’est un antioxydant. Notamment, il maintient le fer à l’état ferreux dans la proline hydroxylase qui assure la transformation de la proline en hydroxyproline et qui n’est active que sous forme ferreuse. Les troubles du scorbut (carence en vitamine C) sont, pour une large part, dus à une altération du collagène (constituant essentiel des tissus conjonctifs), par suite d’une déficience en hydroxyproline.Le glutathion, en abrégé GSH, est un tripeptide formé d’acide glutamique, de cystéine et de glycine (tabl. 1, formules 6). Il participe aux oxydoréductions par création d’un pont disulfure entre deux molécules: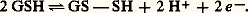 Chez les végétaux, il intervient ainsi dans la réduction des sulfates. Chez les vertébrés, un de ses rôles essentiels est de maintenir le fer de l’hémoglobine à l’état ferreux, comme le fait le cytochrome b 5, et plus encore de la protéger contre l’action des peroxydes, qu’il transforme en eau oxygénée, qu’une catalase décompose en H2O et 2 (fig. 7).L’acide lipoïque est un coenzyme de formule:
Chez les végétaux, il intervient ainsi dans la réduction des sulfates. Chez les vertébrés, un de ses rôles essentiels est de maintenir le fer de l’hémoglobine à l’état ferreux, comme le fait le cytochrome b 5, et plus encore de la protéger contre l’action des peroxydes, qu’il transforme en eau oxygénée, qu’une catalase décompose en H2O et 2 (fig. 7).L’acide lipoïque est un coenzyme de formule: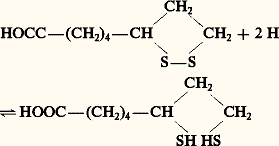 qui peut recevoir 2 H par ouverture du pont disulfure. Il intervient dans la réduction des sulfates (végétaux), mais surtout il assure l’allongement des chaînes dans la synthèse des acides gras (d’où son nom). L’allongement se fait par accrochage d’un radical acétyle 漣CH2 漣COOH, qui doit être réduit en 漣CH2 漣CH2.Certaines cuproprotéines, comme la plastocyanine, de la chaîne photosynthétique, sont des protéines à base de Cu, agissant par le changement de valence Cu+/Cu2+.4. Oxydoréductions et transferts d’énergieLorsqu’un électron – ou plus précisément un électron-gramme, ensemble de N A électrons (N A, nombre d’Avogadro: 6,022 1023) – passe d’un système S1 à un système S2 tel que E2 漣 E1 = 1 V, il libère une énergie de 1 électron-volt (eV):
qui peut recevoir 2 H par ouverture du pont disulfure. Il intervient dans la réduction des sulfates (végétaux), mais surtout il assure l’allongement des chaînes dans la synthèse des acides gras (d’où son nom). L’allongement se fait par accrochage d’un radical acétyle 漣CH2 漣COOH, qui doit être réduit en 漣CH2 漣CH2.Certaines cuproprotéines, comme la plastocyanine, de la chaîne photosynthétique, sont des protéines à base de Cu, agissant par le changement de valence Cu+/Cu2+.4. Oxydoréductions et transferts d’énergieLorsqu’un électron – ou plus précisément un électron-gramme, ensemble de N A électrons (N A, nombre d’Avogadro: 6,022 1023) – passe d’un système S1 à un système S2 tel que E2 漣 E1 = 1 V, il libère une énergie de 1 électron-volt (eV):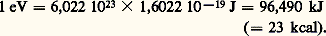 Plus généralement, si n électrons sont impliqués dans l’échange, et si la différence de potentiel qu’ils remontent est E 0 (dans les conditions standard et à pH 7), l’énergie dégagée est égale à la variation d’enthalpie libre du système:
Plus généralement, si n électrons sont impliqués dans l’échange, et si la différence de potentiel qu’ils remontent est E 0 (dans les conditions standard et à pH 7), l’énergie dégagée est égale à la variation d’enthalpie libre du système: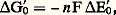 F étant la constante de Faraday, valant 96 490 coulombs (le quotient d’une énergie par un potentiel électrique ayant l’équation aux dimensions d’une quantité d’électricité).À titre d’exemple, les calculs de G 0 ont été donnés à propos des oxydations terminales de la respiration (fig. 4).Destinée de l’énergie dégagéeL’énergie dégagée par une oxydoréduction effectuée dans le sens de la montée des potentiels rédox (chute thermodynamique des électrons) peut avoir trois destinées.D’abord, elle peut se dégager sous forme de chaleur. Il en est obligatoirement ainsi pour une partie (perte thermique), en vertu du deuxième principe de la thermodynamique. Mais, chez les homéothermes (animaux dits «à sang chaud», dont l’homme), la totalité de l’énergie dégagée dans certaines oxydoréductions, réalisées dans des mitochondries spécialisées, assure la thermogenèse, par un mécanisme que nous verrons plus loin.Plus rarement (animaux luminescents: ver luisant, noctiluques), elle peut donner lieu à une émission de lumière, une protéine spéciale, la luciférine, émettant un photon quand elle est oxydée par l’oxygène.Ou bien, elle peut conduire, dans le composé oxydé, à la création d’une liaison à haut potentiel (ou «liaison riche»), qui confère à la molécule un niveau énergétique élevé. Cette liaison, symbolisée par le signe 黎 (tilde), s’hydrolyse facilement avec un fort dégagement d’énergie. Les molécules qui la présentent ont un pouvoir réactionnel élevé et constituent une réserve énergétique pour la cellule. Il s’agit souvent d’une liaison phosphate 黎 OP3H2.Celle-ci peut être transférée sur l’ADP (adénosine-diphosphate), ainsi phosphorylée en ATP (adénosine-triphosphate), laquelle est la principale forme de réserve et de transfert de l’énergie cellulaire. L’énergie ainsi stockée peut être ultérieurement libérée par une hydrolyse et utilisée pour une réaction endergonique.Il en est ainsi dans la glycolyse, lors de l’oxydation du système AldPG/APG, évoqué plus haut (réaction 1 du paragraphe 2). Cette oxydation, réalisée en présence de Pi (phosphate inorganique), par un transporteur d’électrons, le NAD+, conduit à l’acide bisphosphoglycérique (ABPG), PO3H2 漣 CHOH 漣COO 黎 P3H2, qui possède une liaison à haut potentiel, laquelle est transférée sur l’ADP, d’où finalement:
F étant la constante de Faraday, valant 96 490 coulombs (le quotient d’une énergie par un potentiel électrique ayant l’équation aux dimensions d’une quantité d’électricité).À titre d’exemple, les calculs de G 0 ont été donnés à propos des oxydations terminales de la respiration (fig. 4).Destinée de l’énergie dégagéeL’énergie dégagée par une oxydoréduction effectuée dans le sens de la montée des potentiels rédox (chute thermodynamique des électrons) peut avoir trois destinées.D’abord, elle peut se dégager sous forme de chaleur. Il en est obligatoirement ainsi pour une partie (perte thermique), en vertu du deuxième principe de la thermodynamique. Mais, chez les homéothermes (animaux dits «à sang chaud», dont l’homme), la totalité de l’énergie dégagée dans certaines oxydoréductions, réalisées dans des mitochondries spécialisées, assure la thermogenèse, par un mécanisme que nous verrons plus loin.Plus rarement (animaux luminescents: ver luisant, noctiluques), elle peut donner lieu à une émission de lumière, une protéine spéciale, la luciférine, émettant un photon quand elle est oxydée par l’oxygène.Ou bien, elle peut conduire, dans le composé oxydé, à la création d’une liaison à haut potentiel (ou «liaison riche»), qui confère à la molécule un niveau énergétique élevé. Cette liaison, symbolisée par le signe 黎 (tilde), s’hydrolyse facilement avec un fort dégagement d’énergie. Les molécules qui la présentent ont un pouvoir réactionnel élevé et constituent une réserve énergétique pour la cellule. Il s’agit souvent d’une liaison phosphate 黎 OP3H2.Celle-ci peut être transférée sur l’ADP (adénosine-diphosphate), ainsi phosphorylée en ATP (adénosine-triphosphate), laquelle est la principale forme de réserve et de transfert de l’énergie cellulaire. L’énergie ainsi stockée peut être ultérieurement libérée par une hydrolyse et utilisée pour une réaction endergonique.Il en est ainsi dans la glycolyse, lors de l’oxydation du système AldPG/APG, évoqué plus haut (réaction 1 du paragraphe 2). Cette oxydation, réalisée en présence de Pi (phosphate inorganique), par un transporteur d’électrons, le NAD+, conduit à l’acide bisphosphoglycérique (ABPG), PO3H2 漣 CHOH 漣COO 黎 P3H2, qui possède une liaison à haut potentiel, laquelle est transférée sur l’ADP, d’où finalement: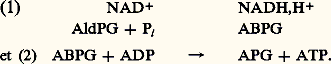 Ainsi, l’oxydation de l’AldPG en APG a entraîné la formation d’ATP. De telles phosphorylations de l’ADP en ATP sont dites phosphorylations liées au substrat, car elles se font par le biais d’une liaison phosphate portée par le substrat (c’est-à-dire le composé réactif, ici l’ABPG).Enfin, il peut y avoir couplage entre l’oxydoréduction et la phosphorylation de l’ADP en ATP (par incorporation de Pi ), c’est-à-dire que les trois réactions (oxydation, réduction, phosphorylation) sont réalisées simultanément dans le même complexe enzymatique. Il en est ainsi dans les phosphorylations oxydatives (dernières étapes de la respiration) et dans les photophosphorylations (photosynthèse).La formation d’une mole d’ATP exige 30 kJ dans les conditions standard (plus dans la réalité). Les oxydoréductions biologiques portant en général sur 2 e size=1漣, il faut, d’après la relation énoncée plus haut, entre les potentiels rédox des systèmes donneur et receveur d’électrons, une dénivellation d’au moins 30/(96,5 憐 2) = 0,16 V pour qu’une oxydoréduction puisse provoquer la synthèse d’une mole d’ATP.La théorie chimioosmotiqueQuel est le mécanisme d’un tel couplage? L’hypothèse actuellement la plus en faveur est la théorie chimioosmotique, élaborée en 1961 pour les phosphorylations oxydatives par l’Anglais Peter Mitchell et sa collaboratrice Jennifer Moyle (elle valut à P. Mitchell le prix Nobel en 1978). Elle fut ensuite étendue aux photophosphorylations (Jagendorf, 1967).Soit une oxydoréduction réalisée sur une crête mitochondriale (repli de la membrane interne de la mitochondrie et siège des phosphorylations oxydatives, fig. 8 a).Elle se déroulerait, selon la théorie de Mitchell, dans un complexe enzymatique, constituant une pompe à protons, telle que l’oxydoréduction aurait provoqué le transport actif de protons de l’intérieur vers l’extérieur (fig. 8 b, à gauche).Déterminant à l’extérieur une plus grande concentration de protons (effectivement le pH est d’environ 7 au voisinage de la mitochondrie, alors qu’il est de 8,4 en son sein), cette différence de concentration entraînerait un flux en retour des H+ vers l’intérieur. Ce flux transiterait par le canal d’ATP synthases, lesquelles sont parfaitement visibles (en microscopie électronique) sur la membrane mitochondriale, où elles forment des saillies globuleuses. Ce flux activerait les ATP synthases y induisant la synthèse d’ATP (fig. 8 c).Pour les photophosphorylations, qui se déroulent sur les thylacoïdes, le processus est le même, mais l’orientation de la membrane thylacoïdale étant inverse de celle d’une crête mitochondriale (fig. 8 b, à droite), c’est vers l’intérieur du thylacoïde que l’oxydoréduction provoque un flux de protons (différence de pH de l’ordre de 3 unités), le flux en retour activant, ici aussi, les ATP synthases (fig. 8 d).Des expériences concluantes, fondées notamment sur l’effet de grandients de pH créés artificiellement entre des organites isolés et leur milieu d’incubation, sont venues étayer cette théorie.De plus, celle-ci explique parfaitement l’effet des découpleurs de phosphorylations, qui sans interrompre le flux des électrons empêchent les phosphorylations correspondantes. C’est ainsi que le 2,4-dinitrophénol (DNP), à de faibles concentrations (de 10 size=1漣5 à 10 size=1漣4 M), n’inhibe pas, dans la respiration, le transfert des électrons à l’oxygène (il le stimule même), mais il bloque les phosphorylations, et le transfert n’est plus producteur d’énergie utilisable. Or le DNP altère la membrane mitochondriale, qui devient perméable aux protons, lesquels reviennent à l’intérieur des mitochondries sans repasser par le canal des ATP synthases.Dans les oxydations terminales (fig. 4), il y a parfaite correspondance entre les émissions de H+ et les phosphorylations. Lorsque la chaîne débute par le NADH, il y a trois sites de phosphorylations, comme le montre le rapport P/O du nombre d’atomes d’oxygène consommés, rapport qui est ici égal à 3: un site entre NADH et Q, un entre Q et c , et un entre c et 2. Lorsque la chaîne part du succinate, il n’y en a plus que deux, car la différence de potentiel rédox entre la sortie et l’entrée du complexe II (0,065 V) n’est pas suffisante. Dans la photosynthèse, il y a sur le trajet acyclique des électrons deux sites de phosphorylations (fig. 4), auxquels s’ajouent des photophosphorylations cycliques sur les retours à partir de Fd.La thermogenèse, qui chez les homéothermes assure la constance de la température du corps, est le fait d’oxydoréductions découplées des phosphorylations. Le mécanisme du découplage est analogue à celui décrit plus haut pour le DNP: la membrane interne de certaines mitochondries, spécialisées dans la thermogenèse, comporte une protéine particulière, la thermogénine, perméable aux protons, et leur permettant, comme le fait le DNP, de revenir au sein de la mitochondrie sans passer par les ATP synthases.5. Rôle des oxydoréductionsLes composés organiques dont sont constitués les êtres vivants sont en général des substances réduites par rapport aux composés oxydés du monde minéral. L’assimilation de ces derniers implique donc globalement une réduction, alors que le retour à l’état minéral traduit une oxydation. Mais l’un et l’autre processus ne peuvent se faire que par paliers. La synthèse d’une mole de glucose à partir de C2 et de H2O exige 2 870 kJ, aucun système biologique ne peut les fournir en une seule fois. Inversement, à la décomposition une libération brutale de près de 3 000 kJ désorganiserait irrémédiablement les structures.Les oxydoréductions s’insèrent dans les systèmes métaboliques qui permettent de passer progressivement de l’état réduit à l’état oxydé ou vice versa. Particulièrement bien adaptées, elles provoquent des échanges d’énergie (de quelques joules à quelques dizaines de joules) suffisamment importants pour assurer des dénivellations métaboliques suffisantes mais compatibles avec le maintien des structures et des activités cellulaires.Les mouvements d’électrons qu’elles entraînent étant le plus souvent accompagnés de mouvements de protons, elles contribuent aussi à l’hydrogénation ou à la déshydrogénation progressive des métabolites lors de leur synthèse ou de leur dégradation: de nombreux exemples peuvent illustrer ces mécanismes de la physiologie cellulaire, que ce soit au niveau des structures d’échange ou des activités sécrétrices.Autre rôle capital: les oxydoréductions exergoniques (descente thermodynamique), comme il s’en trouve dans la respiration et dans la photosynthèse, produisent fréquemment des réducteurs, comme le NAD(P)H, et de l’ATP, c’est-à-dire augmentent les réserves mobiles en pouvoir réducteur et en énergie. Ces réserves sont alors disponibles pour les synthèses et autres activités vitales, au moment et à l’endroit où elles se révèlent nécessaires.Sans doute la compartimentation cellulaire, qui permet la spécialisation des organites en telle ou telle fonction, peut-elle être un obstacle à la libre circulation des réducteurs ou de l’ATP formés. C’est ainsi que le NADPH et l’ATP synthétisés dans le chloroplaste ne peuvent gagner le cytoplasme où ils seraient pourtant utiles à la réduction des nitrates et aux synthèses azotées (l’enveloppe du chloroplaste est imperméable au NADPH et peu perméable à l’ATP). Mais, précisément, ce sont des oxydoréductions qui vont tourner la difficulté, en assurant des cycles réactionnels ou navettes, portant sur des composés, susceptibles, eux, de franchir l’enveloppe grâce à des transporteurs appropriés.La figure 9 fournit un exemple de navette, où le pouvoir réducteur créé dans le chloroplaste se retrouve dans le cytoplasme (sous forme de NADH), ainsi que l’ATP, par le jeu d’oxydoréductions portant sur l’acide phosphoglycérique (APG) et la dihydroxyacétone-phosphate (DHOAP), isomère de l’aldéhyde phosphoglycérique, mentionné plus haut (cf. La notion d’oxydoréduction ).Ce sont également des oxydoréductions qui, chez les animaux à sang chaud, produisent la chaleur et, chez les luminescents, la lumière. Enfin, rôle plus ponctuel, mais non négligeable, nous avons vu comment des oxydoréductions intéressant par exemple le cytochrome b 5, l’acide ascorbique ou le glutathion, pouvaient prévenir les risques d’oxydation, toujours à craindre en milieu aérobie.
Ainsi, l’oxydation de l’AldPG en APG a entraîné la formation d’ATP. De telles phosphorylations de l’ADP en ATP sont dites phosphorylations liées au substrat, car elles se font par le biais d’une liaison phosphate portée par le substrat (c’est-à-dire le composé réactif, ici l’ABPG).Enfin, il peut y avoir couplage entre l’oxydoréduction et la phosphorylation de l’ADP en ATP (par incorporation de Pi ), c’est-à-dire que les trois réactions (oxydation, réduction, phosphorylation) sont réalisées simultanément dans le même complexe enzymatique. Il en est ainsi dans les phosphorylations oxydatives (dernières étapes de la respiration) et dans les photophosphorylations (photosynthèse).La formation d’une mole d’ATP exige 30 kJ dans les conditions standard (plus dans la réalité). Les oxydoréductions biologiques portant en général sur 2 e size=1漣, il faut, d’après la relation énoncée plus haut, entre les potentiels rédox des systèmes donneur et receveur d’électrons, une dénivellation d’au moins 30/(96,5 憐 2) = 0,16 V pour qu’une oxydoréduction puisse provoquer la synthèse d’une mole d’ATP.La théorie chimioosmotiqueQuel est le mécanisme d’un tel couplage? L’hypothèse actuellement la plus en faveur est la théorie chimioosmotique, élaborée en 1961 pour les phosphorylations oxydatives par l’Anglais Peter Mitchell et sa collaboratrice Jennifer Moyle (elle valut à P. Mitchell le prix Nobel en 1978). Elle fut ensuite étendue aux photophosphorylations (Jagendorf, 1967).Soit une oxydoréduction réalisée sur une crête mitochondriale (repli de la membrane interne de la mitochondrie et siège des phosphorylations oxydatives, fig. 8 a).Elle se déroulerait, selon la théorie de Mitchell, dans un complexe enzymatique, constituant une pompe à protons, telle que l’oxydoréduction aurait provoqué le transport actif de protons de l’intérieur vers l’extérieur (fig. 8 b, à gauche).Déterminant à l’extérieur une plus grande concentration de protons (effectivement le pH est d’environ 7 au voisinage de la mitochondrie, alors qu’il est de 8,4 en son sein), cette différence de concentration entraînerait un flux en retour des H+ vers l’intérieur. Ce flux transiterait par le canal d’ATP synthases, lesquelles sont parfaitement visibles (en microscopie électronique) sur la membrane mitochondriale, où elles forment des saillies globuleuses. Ce flux activerait les ATP synthases y induisant la synthèse d’ATP (fig. 8 c).Pour les photophosphorylations, qui se déroulent sur les thylacoïdes, le processus est le même, mais l’orientation de la membrane thylacoïdale étant inverse de celle d’une crête mitochondriale (fig. 8 b, à droite), c’est vers l’intérieur du thylacoïde que l’oxydoréduction provoque un flux de protons (différence de pH de l’ordre de 3 unités), le flux en retour activant, ici aussi, les ATP synthases (fig. 8 d).Des expériences concluantes, fondées notamment sur l’effet de grandients de pH créés artificiellement entre des organites isolés et leur milieu d’incubation, sont venues étayer cette théorie.De plus, celle-ci explique parfaitement l’effet des découpleurs de phosphorylations, qui sans interrompre le flux des électrons empêchent les phosphorylations correspondantes. C’est ainsi que le 2,4-dinitrophénol (DNP), à de faibles concentrations (de 10 size=1漣5 à 10 size=1漣4 M), n’inhibe pas, dans la respiration, le transfert des électrons à l’oxygène (il le stimule même), mais il bloque les phosphorylations, et le transfert n’est plus producteur d’énergie utilisable. Or le DNP altère la membrane mitochondriale, qui devient perméable aux protons, lesquels reviennent à l’intérieur des mitochondries sans repasser par le canal des ATP synthases.Dans les oxydations terminales (fig. 4), il y a parfaite correspondance entre les émissions de H+ et les phosphorylations. Lorsque la chaîne débute par le NADH, il y a trois sites de phosphorylations, comme le montre le rapport P/O du nombre d’atomes d’oxygène consommés, rapport qui est ici égal à 3: un site entre NADH et Q, un entre Q et c , et un entre c et 2. Lorsque la chaîne part du succinate, il n’y en a plus que deux, car la différence de potentiel rédox entre la sortie et l’entrée du complexe II (0,065 V) n’est pas suffisante. Dans la photosynthèse, il y a sur le trajet acyclique des électrons deux sites de phosphorylations (fig. 4), auxquels s’ajouent des photophosphorylations cycliques sur les retours à partir de Fd.La thermogenèse, qui chez les homéothermes assure la constance de la température du corps, est le fait d’oxydoréductions découplées des phosphorylations. Le mécanisme du découplage est analogue à celui décrit plus haut pour le DNP: la membrane interne de certaines mitochondries, spécialisées dans la thermogenèse, comporte une protéine particulière, la thermogénine, perméable aux protons, et leur permettant, comme le fait le DNP, de revenir au sein de la mitochondrie sans passer par les ATP synthases.5. Rôle des oxydoréductionsLes composés organiques dont sont constitués les êtres vivants sont en général des substances réduites par rapport aux composés oxydés du monde minéral. L’assimilation de ces derniers implique donc globalement une réduction, alors que le retour à l’état minéral traduit une oxydation. Mais l’un et l’autre processus ne peuvent se faire que par paliers. La synthèse d’une mole de glucose à partir de C2 et de H2O exige 2 870 kJ, aucun système biologique ne peut les fournir en une seule fois. Inversement, à la décomposition une libération brutale de près de 3 000 kJ désorganiserait irrémédiablement les structures.Les oxydoréductions s’insèrent dans les systèmes métaboliques qui permettent de passer progressivement de l’état réduit à l’état oxydé ou vice versa. Particulièrement bien adaptées, elles provoquent des échanges d’énergie (de quelques joules à quelques dizaines de joules) suffisamment importants pour assurer des dénivellations métaboliques suffisantes mais compatibles avec le maintien des structures et des activités cellulaires.Les mouvements d’électrons qu’elles entraînent étant le plus souvent accompagnés de mouvements de protons, elles contribuent aussi à l’hydrogénation ou à la déshydrogénation progressive des métabolites lors de leur synthèse ou de leur dégradation: de nombreux exemples peuvent illustrer ces mécanismes de la physiologie cellulaire, que ce soit au niveau des structures d’échange ou des activités sécrétrices.Autre rôle capital: les oxydoréductions exergoniques (descente thermodynamique), comme il s’en trouve dans la respiration et dans la photosynthèse, produisent fréquemment des réducteurs, comme le NAD(P)H, et de l’ATP, c’est-à-dire augmentent les réserves mobiles en pouvoir réducteur et en énergie. Ces réserves sont alors disponibles pour les synthèses et autres activités vitales, au moment et à l’endroit où elles se révèlent nécessaires.Sans doute la compartimentation cellulaire, qui permet la spécialisation des organites en telle ou telle fonction, peut-elle être un obstacle à la libre circulation des réducteurs ou de l’ATP formés. C’est ainsi que le NADPH et l’ATP synthétisés dans le chloroplaste ne peuvent gagner le cytoplasme où ils seraient pourtant utiles à la réduction des nitrates et aux synthèses azotées (l’enveloppe du chloroplaste est imperméable au NADPH et peu perméable à l’ATP). Mais, précisément, ce sont des oxydoréductions qui vont tourner la difficulté, en assurant des cycles réactionnels ou navettes, portant sur des composés, susceptibles, eux, de franchir l’enveloppe grâce à des transporteurs appropriés.La figure 9 fournit un exemple de navette, où le pouvoir réducteur créé dans le chloroplaste se retrouve dans le cytoplasme (sous forme de NADH), ainsi que l’ATP, par le jeu d’oxydoréductions portant sur l’acide phosphoglycérique (APG) et la dihydroxyacétone-phosphate (DHOAP), isomère de l’aldéhyde phosphoglycérique, mentionné plus haut (cf. La notion d’oxydoréduction ).Ce sont également des oxydoréductions qui, chez les animaux à sang chaud, produisent la chaleur et, chez les luminescents, la lumière. Enfin, rôle plus ponctuel, mais non négligeable, nous avons vu comment des oxydoréductions intéressant par exemple le cytochrome b 5, l’acide ascorbique ou le glutathion, pouvaient prévenir les risques d’oxydation, toujours à craindre en milieu aérobie.
Encyclopédie Universelle. 2012.
